الصحة تسحب عقار "زانتاك" من الأسواق لاحتوائه على شوائب مسرطنة
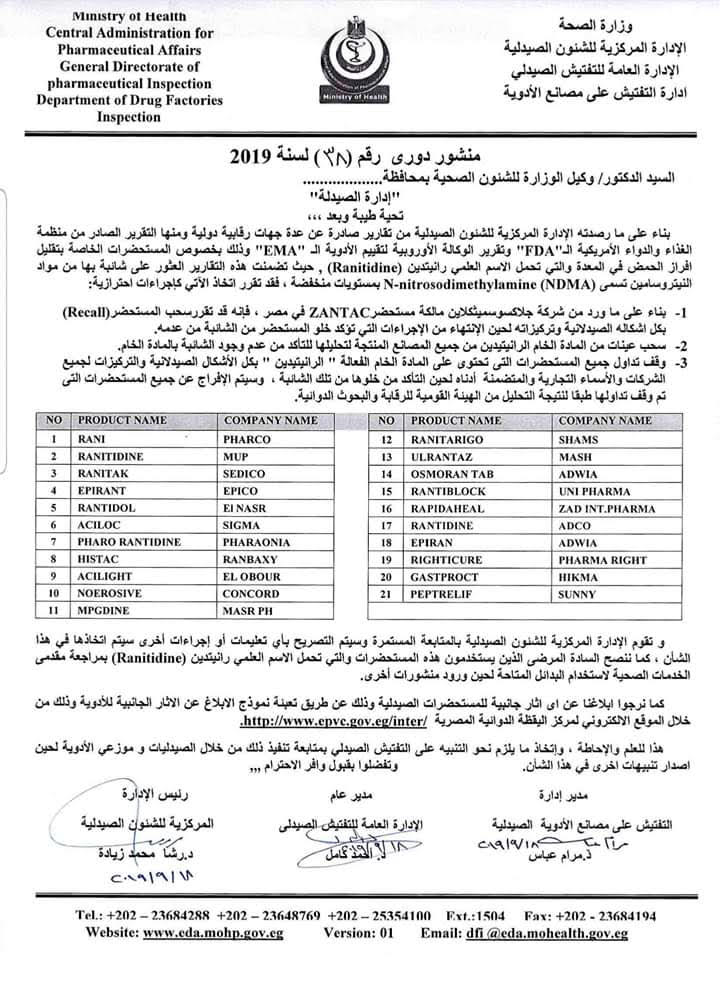
وشدد المنشور الصادر عن إدارة الصيدلة، والذي حمل رقم 38 لعام 2019 أنه تم مخاطبة الشركة المنتجة، لسحب كل التشغيلات من السوق لحين ثبوت عدم احتوائها على شوائب مسرطنة.
وأكدت إدارة الغذاء والدواء الأمريكية أن بعض الأدوية التي تحتوي على مادة "رانيتيدين" بما في ذلك بعض المنتجات المعروفة باسم دواء Zantac الذي يحمل الاسم التجاري، تحتوي على شوائب نيتروسامين تسمى Nnitrosodimethylamine NDMA بمستويات منخفضة حيث يتم تصنيف NDMA كمادة مسرطنة محتملة للإنسان (مادة يمكن أن تسبب السرطان) بناءً على نتائج الاختبارات المعملية.
ويعرف NDMA بالملوث البيئي المعروف ويوجد في الماء والأطعمة، بما في ذلك اللحوم ومنتجات الألبان والخضروات.
وتقوم إدارة الأغذية والعقاقير (FDA) بالتحقيق في NDMA وغيرها من شوائب النتروزامين في أدوية ضغط الدم وفشل القلب التي تسمى حاصرات مستقبلات Angiotensin II ARBs منذ العام الماضي، في حالة ARBs.
وأوصت إدارة الأغذية والعقاقير بالعديد من عمليات الاسترجاع لأنها اكتشفت مستويات غير مقبولة من النتروزامين.
وتمت الموافقة على استخدام الرانيتيدين بدون وصفة طبية لمنع وتخفيف حرقة المعدة المرتبطة بتناول الحمض والمعدة الحامضة.
وتم اعتماد وصفة طبية رانيتيدين لعدة مؤشرات، بما في ذلك العلاج والوقاية من قرحة المعدة والأمعاء وعلاج مرض الجزر المعدي المريئي.
وأكدت الوكالة أنها تعمل مع المنظمين الدوليين وشركاء الصناعة لتحديد مصدر هذا الشوائب في الرانيتيدين، وتقوم الوكالة بفحص مستويات NDMA في رانيتيدين وتقييم أي خطر محتمل على المرضى، وستتخذ إدارة الأغذية والعقاقير التدابير المناسبة بناءً على نتائج التحقيق الجاري. ستوفر الوكالة المزيد من المعلومات عند توفرها.
وأوضحت إدارة الأغذية والعقاقير أنها لا تدعو الأفراد للتوقف عن تناول رانيتيدين في هذا الوقت؛ ومع ذلك، يجب على المرضى الذين يتناولونه بوصفة طبية والذين يرغبون في التوقف عن الاستخدام التحدث إلى إخصائي الرعاية الصحية لديهم بشأن خيارات العلاج الأخرى.











اترك تعليق